| Startseite | | | Nachrichten | | | Grundlagen | | | Forscher | | | Geschichte | | | Links | | |
Schwerpunkte |
| | FAQ (Eng.) | | |
ATP-Synthase-Grundlagen
Hier ist eine kurze Beschreibung dieses wundervollen Enzyms.
Wenn Sie ausführlichere allgemeine Informationen benötigen,
sehen Sie bitte FAQ (zur Zeit nur auf
Englisch) oder das
Vorlesungskript von Prof. A. Crofts (auch
hier zu finden (Universität Hamburg)) auf Englisch.
|
Dieses Enzym ist der Primärproduzent von ATP in der
überwiegenden
Mehrheit aller auf der Erde lebender Lebewesen, einschließlich
uns. Im menschlichen Körper erzeugt es täglich über 100
Kilo ATP, das
anschließend
benutzt wird, um Energie für unterschiedliche biochemische
Reaktionen,
einschließlich der DNA- und Proteinsynthese, der
Muskelkontraktion,
des Transportes der Nährstoffe und der neuralen Aktivität (um
nur einiger zu nennen), bereit zu stellen. In Pflanzen und photosynthetischen Bakterien ist es für die Umwandlung der Sonnenenergie in chemische Energie und die Kohlenstofffixierung von großer Bedeutung. Es ist eines der ältesten Enzyme auf der Erde, das in der Evolution vor den photosynthetischen Enzymen oder den Enzymen der Atmungsketten entstanden ist. Die ATP-Synthase ist ein Membranenzym. Es ist in Eu- und Archaebakterien in der Plasmamembranlokalisiert; außerdem ist es in den Thylakoidmembranen der Chloroplasten und in den inneren Mitochondriemebranen der eukariotischen Zellen vorhanden. ATP-Synthasen unterschiedlicher Organismen zeigen auffällige Homologien in der Primärstruktur der Untereinheiten, die für die Katalyse wesentlich sind. Wie vom Namen des Enzyms abgeleitet werden konnte, katalysiert es die Reaktion der ATP Synthese. Auf der Gegenseite kann es auch die Hydrolyse von ATP katalysieren. Die katalytische Aktion wird mit einer vektoriellen Transmembraneverschiebung einiger Protone verbunden. Die Antriebskraft für die ATP Synthese ist das elektrochemische transmembranes Potentialdifferenz des Protons, während bei der ATP Hydrolyse diese Potentialdifferenz durch die Spaltung der energiereichen phosphodietherischen Bindungen im ATP-Molekule errichtet wird.  |
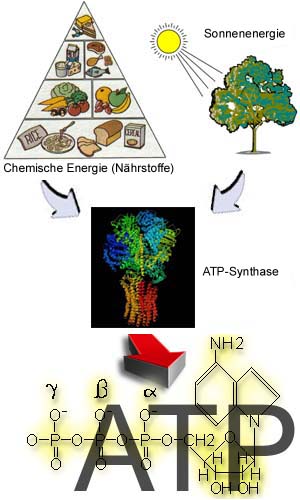 |
Die Gesamtgleichung ATP Synthese/Hydrolyse lautet:
ADP3- + HPO42- + H+ + nH+außen <=> ATP4- + H2O + nH+innen
wobei die Indices "außen" und "innen" für die äußere (positiv aufgeladene) und innere (negativ aufgeladene) Seite der Membran stehen.
Die Struktur dieses Enzyms ist ziemlich kompliziert. Es ist ein
asymetrischer Proteinkomplex aus mehreren Untereinheiten mit einer
ungefähren Gesamtmolekularmasse von 500 kDa. Funktionell und
strukturell kann dieses Enzym in zwei unterschiedliche Domänen
eingeteilt werden. Der hydrophobische Fo-Teil ist in der
Membran eingebettet und führt die Protonverschiebung durch,
während hydrophile F1-Teil in die wäßrige
Phase herausragt und die eigentliche ATP-Synthese/Hydrolyse
durchführt.
Während der Katalyse rotiert ein Komplex aus einigen
Untereinheiten des F1-Teils im Verhältnis zum Rest des
Enzyms. Diese Eigenschaft macht die ATP-Synthase zum kleinsten
bekannten Drehmotor überhaupt.
| Boris A.
Feniouk |
Sommer 2002 |